Comprendre le procédé de déchloration est une tâche complexe et nécessite de comprendre plusieurs autres concepts connexes comme ce qu’est la chloration ou à quoi elle sert. De plus, il ne faut pas négliger l’importance de définir plus en détail ce qu’est le chlore et quels sont ses dérivés.
C'est quoi la chloration
La chloration de l’eau est une technique de désinfection chimique permettant la désactivation des micro-organismes pouvant être dangereux pour la santé. Pour procéder à la chloration de l’eau, il suffit d’ajouter du chlore ou un de ses dérivés à l’eau. Lorsqu’ajouté à l’eau, le pouvoir oxydant du chlore vient s’attaquer à l’ADN des micro-organismes afin de les désactiver et les empêcher de se reproduire. Dans certains cas, une étape de filtration doit être ajoutée pour extraire les corps morts de l’eau.
L’ajout du chlore dans l’eau peut se faire sous toutes ses formes : liquide, gazeuse ou solide. Typiquement, les techniques de chloration les plus répandues sont l’ajout de chlore liquide et l’ajout d’un dérivé du chlore, la chloramine.
Qu'est-ce que la déchloration
La déchloration est un procédé d’extraction des résidus de chlore provenant d’une étape de chloration. Que ce soit dans le but d’extraire le chlore libre, le chlore total, le chlore combiné ou tout autre type de dérivés du chlore, les techniques de déchloration permettent généralement de diminuer drastiquement la présence de ces composés chimiques pouvant affecter l’eau.
Les traces de chlore peuvent provenir de vos installations lorsque vous effectuez la désinfection de l’eau ou des équipements. Elles peuvent aussi provenir de votre alimentation en eau. En effet, si l’usine de traitement d’eau municipale à laquelle vous êtes connectés utilise du chlore ou un dérivé, des résidus peuvent être trouvés.
Plusieurs raisons justifient l’ajout d’une étape de déchloration. On peut penser à la réduction du goût et des odeurs causées par la présence de chlore.
- À titre d’exemple, la forte odeur des piscines municipale et le goût particulier de l’eau sont causés par une forte concentration de chlore visant à désinfecter continuellement l’eau.
En plus d’affecter les caractéristiques esthétiques de l’eau, la présence de chlore dans l’eau peut impacter l’intégrité des équipements de traitement d’eau. En effet, le pouvoir oxydant du chlore peut accélérer l’usure des systèmes. En plus d’une usure prématurée des systèmes, les résidus de chlore auront un impact négatif sur les membranes de filtration (microfiltration, ultrafiltration, nanofiltration & osmose inverse).
Le chlore et ses dérivées
Pour commencer, peu importe le type de chlore ajouté à l’eau, lorsque celui-ci est ajouté à l’eau, il se divise en trois catégories : le chlore libre, le chlore combiné et le chlore total.
C'est quoi du chlore?
De symbole Cl, le chlore est un élément chimique membre du groupe des halogènes qui se forme de deux atomes de chlore qui sont liés de façon covalente et possédant une valence de 7. À son état naturel, le chlore est un gaz jaunâtre qui est toxique et corrosif. Grâce aux avancés technologiques, le chlore est maintenant disponible sous trois formes : gazeux, liquide et solide.
Le chlore libre
Il s’agit du nombre d’ions de chlore disponible pour s’attaquer aux contaminants présents dans l’eau. En d’autres mots, on qualifie le chlore libre comme étant la quantité de chlore disponible pour la désinfection de l’eau.
C’est donc pour dire que la présence ou l’absence de chlore libre signifie la capacité ou l’incapacité du chlore d’effectuer la désinfection. C’est pourquoi c’est ce paramètre qu’il faut surveiller lors de la chloration.
Le chlore combiné
On qualifie le chlore combiné d’ions de chlore qui se sont combinés aux différents contaminants présents dans l’eau. Cela signifie que le chlore combiné a déjà utilisé sa capacité oxydante dans le but d’éliminer des contaminants.
C’est pourquoi le chlore combiné se manifeste durant la désinfection de l’eau puisque les ions de chlore se combinent.
Le chlore total
De façon simple, le chlore total représente l’addition du chlore libre et du chlore combiné présent dans l’eau. Si vous connaissez les quantités de chlore libre et combiné dans votre eau, voici la formule permettant de calculer la quantité de chlore total dans celle-ci
- Chlore libre + Chlore combiné = Chlore total
Les technologies d’identification du chlore sont nombreuses, mais les moins coûteuses et donc, les plus répandues sont celles permettant de connaitre les quantités de chlore totales dans l’eau. En revanche, bien qu’il soit relativement facile et peu coûteux d’identifier la quantité de chlore total présent dans l’eau, il s’avère parfois inutile de le savoir. En effet, sans avoir d’informations sur les concentrations de chlore libre et de chlore combiné, il est pratiquement inutile de savoir combien de chlore total se trouve dans l’eau puisqu’on ne peut savoir si le chlore présent est en mesure de traiter les contaminants dans l’eau ou s’il a déjà été utilisé.
Le dioxyde de chlore
Le dioxyde de chlore (ClO2) est un gaz synthétique qui provient de l’amalgame entre des atomes de chlore et d’oxygène. Lorsqu’ajouté à de l’eau, le ClO2 est un radical libre qui réagit fortement avec les agents réducteurs et qui se dissocie en gaz de chlore en gaz d’oxygène et en chaleur. Lorsqu’il se désagrège, le dioxyde de chlore produit du chlorure (Cl), du chlorite (ClO) et du chlorate (ClO3).
Lorsqu’il est ajouté à l’eau, le dioxyde de chlore n’entraîne pas d’hydrolyse, ce qui signifie qu’il reste à l’état de gaz dissout en solution. De plus, en comparaison au chlore, le dioxyde de chlore présente une solubilité environ 10 fois supérieure.
Les chloramines
Aussi connue sous le nom de monochloramine et de formule NH2CL, la chloramine est un agent oxydant le plus souvent utilisé en solution diluée. Le NH2CL est utilisé en solution diluée puisque sous forme concentrée, elle est hautement instable et encore plus instable sous forme de liquide pur. À titre d’exemple, le NH2Cl se décompose de façon violente à une température supérieure à -40°C.
Les chloramines sont fabriquées en ajoutant de l’ammoniac dans de l’eau contenant du chlore libre. Le chlore libre peut être sous forme HOCl ou OCl, en fonction du pH de la solution. Pour que la réaction soit idéale, l’eau doit présenter un caractère alcalin et un pH de 8,4. L’importance du pH de la solution s’explique puisque sa valeur déterminera le type de chloramine qui sera formé. En effet, trois différents types de chloramines inorganiques peuvent être formés par ce mélange. Les trichloramine qui sont généralement formés lorsque le pH est inférieur à 3. La dichloramine se formera lorsque le pH se situe entre 3 et 7. Finalement la monochloramine, le résultat recherché, se forme lorsque le pH est supérieur à 7.
Plus techniquement, la synthèse est réalisée en solution diluée, car la réaction se fait lorsque HClO est attaqué par le nucléophile NH3. Cette synthèse permettra de générer de la monochloramine en solution pour utilisation en traitement d’eau. À titre informatif, la préparation du composé pur se fait grâce au contact de la fluoramine avec du chlorure de calcium : NH2F + CaCl2 -> NH2Cl + CaCIF.
En comparaison au chlore, la chloramine présente deux avantages. Pour commencer, l’eau traitée à la chloramine présente une odeur et un goût plus plaisant que l’eau traitée au chlore. En revanche, le principal avantage relié à la chloramine est qu’elle est plus stable que le chlore. Ce qui fait que le traitement est beaucoup plus durable, donc moins de recontamination.
Les techniques d’extraction du chlore
Maintenant qu’on comprend un peu mieux le fonctionnement des étapes de chloration et des différents types de chlore, regardons les technologies permettant la déchloration. Typiquement, les technologies les plus répandues pour l’extraction du chlore sont le charbon activé, le métabisulfite de sodium, l’irradiation UV ou dans certains cas, l’ajout de peroxyde d’hydrogène.
Charbon activé
Afin de bien comprendre comment le charbon activé retire le chlore et la chloramine de l’eau, il est important de préciser que lorsqu’un de ces deux produits est ajouté à l’eau, de l’acide hypochloreux (HOCl) se forme. Celle-ci se dissout éventuellement pour former des ions hypochlorite (OCl-). Le charbon actif effectue la déchloration de l’eau grâce au potentiel d’oxydation du chlore et de ses dérivés. Les réactions d’oxydation se produisent à la surface du charbon lorsque l’eau rentre en contact avec le lit de charbon.
Les réactions d’oxydations sont les suivantes
- Charbon + HOCL ->C*O + H + Cl-
- Charbon + OCL- -> C*O + Cl-
- Le symbole « * » signifie le composé oxydé par le chlore qui s’est ensuite dissout en ion d’hypochlorite.
C’est pourquoi, au fil du temps, les lits de charbon deviennent plus efficaces pour éliminer le chlore puisqu’ils captent des matières organiques. La captation de ces matières organiques promeut la formation des bactéries puisque le lit de charbon devient un terrain fertile pour les bactéries.
Lorsque le charbon est utilisé pour l’extraction des chloramines, le principe est sensiblement le même, mais la réaction chimique est différente. Cela est causé par le pouvoir oxydant plus faible de la chloramine. Petite parenthèse, lorsque la chloramine est formée, plusieurs dérivés peuvent se former. Le type de chloramine formé changera en fonction du pH de l’eau. La très grande majorité du temps, c’est des monochloramine qui sont formées.
Enfin, précisons que les charbons activés standard ne sont pas particulièrement efficaces pour l’élimination des chloramines. Cela est dû au fait que le potentiel d’oxydation de la chloramine est beaucoup plus faible que celui du chlore. C’est pourquoi il est conseillé d’utiliser des charbons activé et catalytique pour le traitement des chloramines.
Le métabisulfite de sodium
De formule N2S2O5, le métabisulfite de sodium est un composé inorganique utilisé dans le milieu du traitement d’eau en tant qu’agent de réduction. Lorsqu’il est ajouté à de l’eau, les SMBS produisent du dioxyde de souffre et opère comme capteur d’oxygène afin d’éliminer l’oxygène dissout dans l’eau.
- Sa caractéristique de capteur d’oxygène fait que sa présence crée un milieu anaérobie qui promeut l’encrassement biologique des membranes si une trop grosse quantité de SMBS est ajoutée.
Typiquement, lorsque le métabisulfite de sodium est utilisé dans le traitement d’eau, c’est avec l’objectif de réduire directement le chlore libre et les chloramines présent dans l’eau.
En fonction du type de contaminants à retirer, la réaction chimique causée par le métabisulfite de sodium varie.
Lorsque l’extraction du chlore libre est l’objectif, la réaction suivante surviendra :
- Na2S2O5 + 3H2O + 2Cl2 -> NaHSO4 + 2HCl
Si l’objectif visé est l’extraction des chloramines, on obtiendra la réaction suivante
- Na2S2O5 + 9H2O + 2NH3 + 6Cl2 -> 6NaHSO4 + 10HCl + 2NH4Cl
Puisque les réactions engendrées par l’ajout de métabisulfite de sodium sont pratiquement instantanées, il faut s’assurer que les quantités ajoutées sont suffisantes pour l’extraction entière des résidus de chlore. Typiquement, les quantités requises pour la déchloration au SMBS ressemblent à cela.
- 38mg de métabisulfite de sodium permettra de retirer 1.0mg de chlore
- 86mg de métabisulfite de sodium permettra de retirer 1.0mg de chloramine
Puisqu’une quantité connue de SMBS permet le traitement d’une quantité connue de chlore ou de chloramine, on comprend que dans une alimentation en eau où la présence de ces contaminants est variable, les SMBS ne sont pas idéals puisque les quantités requises au traitement peuvent changer de façon importante. Rappelons qu’une trop grande quantité de métabisulfite de sodium accentue les chances de biocontamination et qu’une quantité insuffisante ne retirera pas toute le chlore ou la chloramine.
L'irradiation Ultraviolette
Gagnant en popularité, l’utilisation de lumière ultraviolette pour la déchloration est une technique qui présente l’avantage d’effectuer la désinfection de l’eau au même moment, qui est sans produit chimique et qui demande un entretien des plus simples. En revanche, pour effectuer la déchloration de manière efficace, une grande quantité d’ultraviolet est nécessaire et ceux-ci peuvent dégager une chaleur importante.
Bref, lorsque les rayons UV rentrent en contact avec les molécules d’HOCl et OCL-, une réaction de photolyse survient afin de venir dissocier les atomes formant les molécules contaminantes.
Les coûts reliés aux technologies de déchloration
Évidemment, les coûts associés à l’achat et à l’utilisation des différentes techniques de déchloration varient grandement en fonction des différentes situations
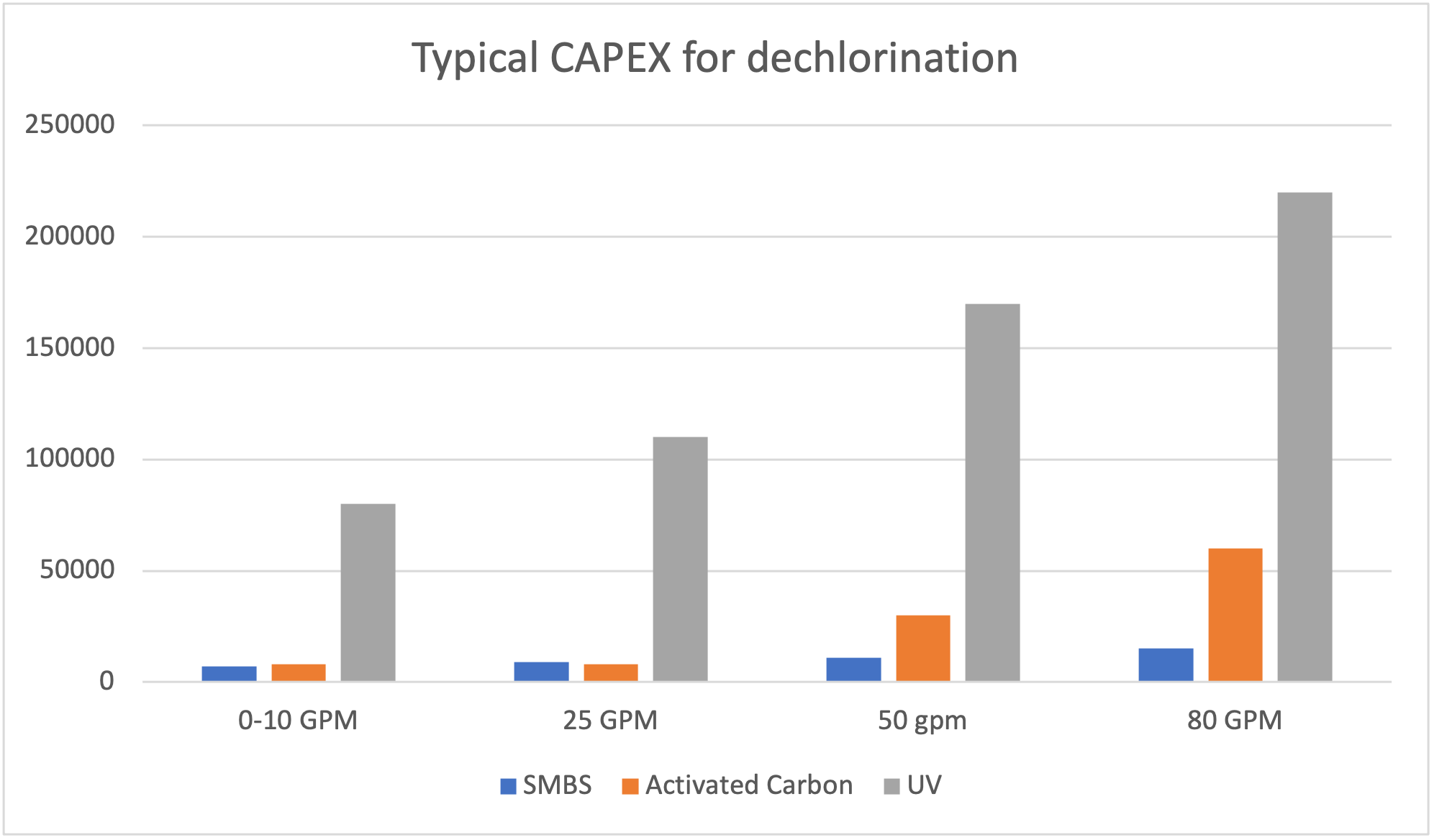
- À noter que le charbon activé, comparer ici est du charbon standard.
Les coûts annuels reliés à l’utilisation des différentes techniques de déchloration incluent l’achat des produits chimiques si nécessaire, l’entretien des équipements, le coût relié à l’énergie utilisé pour le fonctionnement des systèmes et toute autre dépense associé.
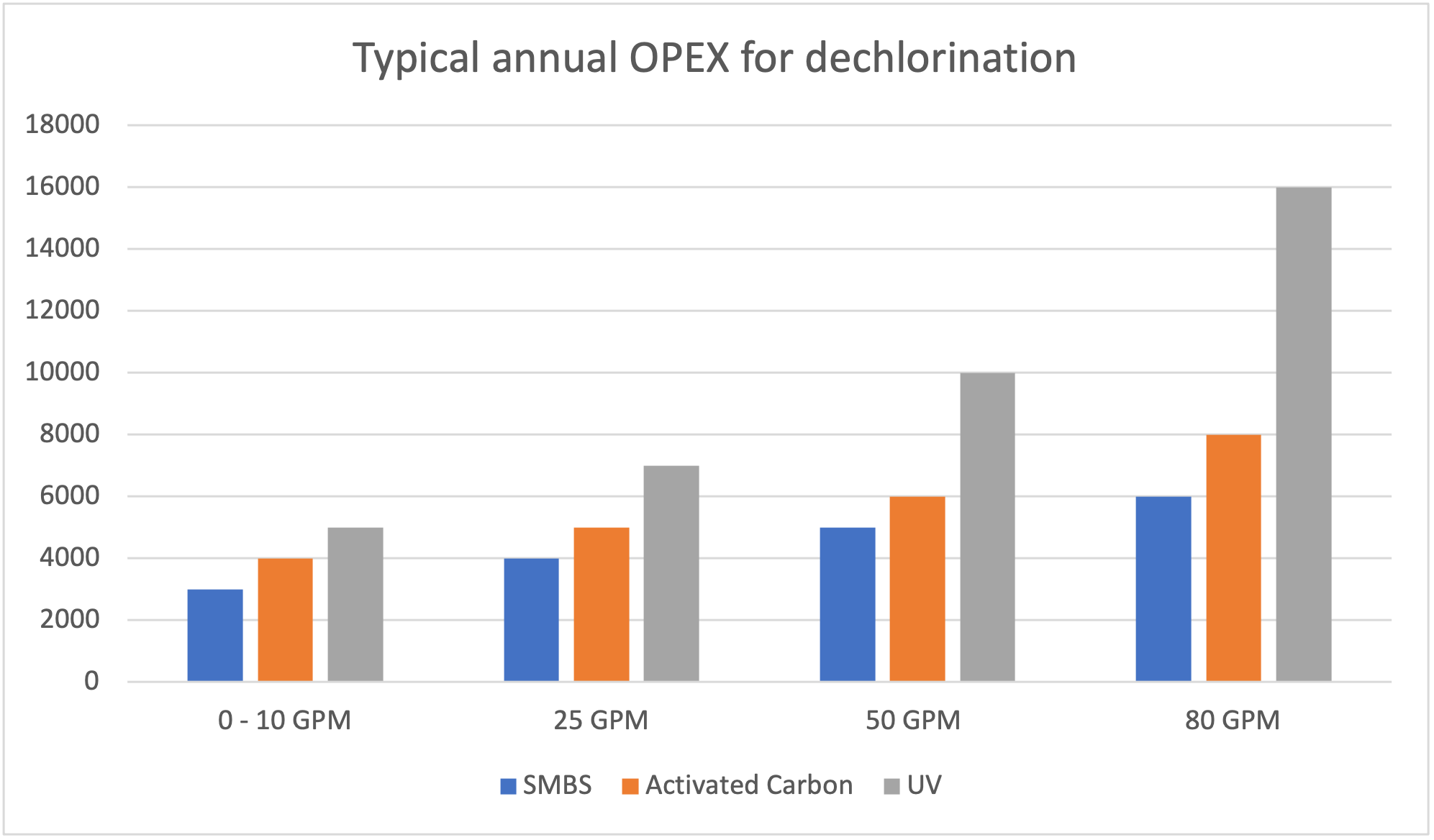
Une déchloration pour chaque situation
Les trois techniques de déchloration qui ont été abordées sont les plus répandues et les plus efficaces. Toutefois, elles ne sont pas les seules, on peut notamment penser à l’ajout de peroxyde d’hydrogène. Il est important de rappeler que la déchloration n’est pas seulement utile pour l’amélioration des caractéristiques esthétique de l’eau, elle présente aussi des avantages relativement à l’intégrité des équipements puisque le pouvoir oxydant des dérivés du chlore peut abîmer les différents équipements.
Bref, nous espérons que ces explications vous ont aidé à mieux comprendre le procéder de déchloration et ces différentes technologies. Si vous avez des questions, n’hésitez pas à nous écrire et il nous fera plaisir de répondre à vos interrogations.